Валидация определения. Валидация процессов производства и предоставления услуг. Что же все-таки это такое? й международный проект «Созвездие качества’2012»
Определение валидации
По определению PIC/S- это действия, которые в соответствии
с принципами GMP доказывают, что
определенная методика, процесс,
оборудование, сырье, деятельность или
система действительно приводят к
ожидаемым результатам
Цель валидации
Доказать, что объект валидациидействительно приводит к
ожидаемым результатам Процедура процесса валидации должна
быть зафиксирована в ряде протоколов и
результаты валидации должны быть
зафиксированы в записях или отчетах.
Эти документы используются в разных
формах при получении регистрационного
удостоверения и инспекции в соответствии с
правилами GMP и так же, для внутренних
производственных целей, чтобы руководство
организации могло быть уверено в том, что
оно контролирует свои процессы.
План мероприятий по валидации
- это документ, затрагивающийпроизводственную деятельность всего
предприятия и уточняющий сроки валидации
и перечни оборудования, систем, методов и
технологических процессов, которые подлежат
валидации
В плане мероприятий по валидации должны быть:
представленформат составления того или иного документа по
валидации (в частности, по валидации оборудования и систем с точки
зрения монтажной квалификации, операционной квалификации и
эксплуатационной квалификации; по валидации технологического
процесса; по валидации результатов аналитических испытаний), а
также уточнен тот объем информации, который следует отразить в
каждом документе.
указаны причины и сроки повторной валидации
изложена последовательность проведения валидации на каждом
производственном участке
оговорены конкретные меры на случай каких-либо отклонений от
перечисленных испытаний и сроки, по истечению которых,
допускается очередная валидация
Валидация аналитических методик
Валидация аналитической методики – этопроцесс, посредством которого, путем
лабораторных испытаний устанавливают, что
характеристики методики соответствуют
требованиям предполагаемых аналитических
испытаний, где главной задачей является
экспериментальное доказательство того, что
данная методика пригодна для достижения тех
целей, для которых она предназначена.
Валидация аналитической методики
Валидация является документированнойпроцедурой, дающей высокую степень уверенности
в том, что конкретный процесс, метод или система
будет последовательно приводить к результатам,
отвечающим заранее установленным критериям
приемлемости.
В соответствии с международными требованиями по
валидации аналитических методов любая
разрабатываемая или модифицируемая
аналитическая методика должна оцениваться с точки
зрения обоснованности и объективности ее
использования.
Цель аналитической валидации
- гарантия, что выбранная аналитическая методикабудет давать воспроизводимые и достоверные
результаты, соответствующие поставленной цели.
Необходимо надлежащим образом определить
как условия применения методики, так и цель, для
которой она предназначена.
Валидации подвергаются аналитические методы, применяемые для:
1. Идентификации лекарственного вещества.2. Установления пределов содержания примесей
родственных
соединений,
тяжелых
металлов,
остаточных
органических растворителей.
3. Количественного определения лекарственного
вещества, лекарственного вещества (веществ) в
составе лекарственных форм, индивидуальных
примесей
и
суммы
примесных
продуктов,
консервантов.
Параметры валидации аналитического метода
ПравильностьПрецизионность
Специфичность
Предел обнаружения или чувствительность
Предел количественного определения
Линейность
Аналитическая область (диапазон)
Устойчивость (робастность)
Правильность (accuracy, trueness)
аналитического метода характеризует близость результатовиспытаний, полученных данным методом, к истинному
значению.
Показателем правильности метода обычно является значение
систематической погрешности.
Систематическая погрешность выражается как разность между
математическим ожиданием результатов измерений и истинным
значением.
Правильность оценивается на основе не менее 9 результатов
определений на минимум 3 уровнях концентраций в пределе
аналитической области (например, 3 повторности определения
для 3 аналитических концентраций).
Прецизионность (precision)
аналитической методики выражает близостьрезультатов (степень разброса) серий измерений,
полученных на множестве проб одного образца
при заданных условиях.
Обычно исследуют 3 уровня прецизионности:
- повторяемость
- промежуточную прецизионность
- воспроизводимостьПовторяемость – мера прецизионности при одинаковых
условиях эксплуатации в течение короткого промежутка
времени, то есть при нормальных условиях эксплуатации
аналитической методики на одном и том же оборудовании.
Этот показатель иногда называется внутриопытной
прецизионностью (презиционность повторяемости).
По рекомендации ICH повторяемость следует оценивать,
используя результаты как минимум девяти определений,
охватывающих установленный диапазон методик (например,
три концентрации/три повторности, как в испытании на
правильность), или как минимум шести определений при
100%-ной концентрации испытуемого раствора.
Требуется представление вычисленного стандартного
отклонения, относительного стандартного отклонения
Промежуточная прецизионность – вариабельность внутри
одной лаборатории.
Стандартными определяемыми параметрами при этом
являются вариабельности по дням, аналитикам и оборудованию.
ICH
разрешает
не
определять
промежуточную
прецизионность,
если
доказана
воспроизводимость.
Предполагается, что промежуточная прецизионность должна
показывать вариабельность того же порядка или меньшую, чем
вариабельность при воспроизводимости.
ICH рекомендуют включать в отчет значения стандартного
отклонения,
относительного
стандартного
отклонения
(коэффициента вариации) и доверительного интервала.Воспроизводимость – измеряет межлабораторную
прецизионность.
Этот параметр рассматривается при стандартизации
аналитической методики (например, при включении
методики в фармакопеи и переносе методики между
разными лабораториями).
Для валидации данной характеристики следует провести
одинаковые исследования в разных лабораториях, используя
одинаковые однородные испытуемые образцы и одинаковый
план эксперимента.
способностью достоверно определять лекарственное
вещество в присутствии примесных соединений,
продуктов деградации и вспомогательных веществ
Специфичность оценивается при валидации
методов, применяемых для:
- идентификации лекарственных веществ,
- определения примесей (родственные соединения,
тяжелые металлы, летучие органические примеси),
- установления количественного содержания вещества в
образце и лекарственной форме.
Специфичность аналитического метода
В испытаниях на подлинность аналитический метод долженобеспечивать идентификацию лекарственного вещества в присутствии
других соединений близкой химической структуры. Это должно быть
подкреплено получением положительных результатов (путем сравнения со
стандартом) анализа образца, содержащего лекарственное вещество, а
также отрицательными результатами анализа образца, не содержащего
такого вещества, для подтверждения того, что положительный результат не
может быть обусловлен присутствием других, сходных по строению с ним
веществ.
В тех случаях, когда примесные соединения и продукты деградации не
идентифицированы или их стандартные образцы отсутствуют,
специфичность аналитического метода должна быть обоснована
результатами определений другим, независимым валидированным методом.
В этом случае анализируемые образцы следует подвергать стрессовым
воздействиям (свет, температура, влажность, кислотный/щелочной
гидролиз, окисление).
Специфичность аналитического метода
Приколичественном
определении
примесей
специфичность метода может быть доказана добавлением к
лекарственному веществу соответствующих количеств
примесей или вспомогательных веществ для доказательства
того, что присутствие этих веществ не влияет на результат
анализа.
Предел обнаружения (ПО)
минимальное количество аналита в пробе, которое можетбыть обнаружено, но не обязательно определено в
количественном
отношении
при
заданных
условиях
эксперимента.
Предел обнаружения выражается как концентрация аналита
в пробе, например, в процентах, частях на миллион (ррт) или
частях на миллард (ррb).
Предел обнаружения (ПО)
Существует несколько подходов для определения ПО:- при валидации инструментальных методик наличие фонового шума обычно
сравнивают измеряемые сигналы от образцов с известными низкими концентрациями
аналита с контрольными (холостыми) пробами.
Минимальная концентрация, при которой аналит может быть достоверно определен,
устанавливается путем использования приемлемого соотношения сигнал/шум 2:1 или
3:1. Представление соответствующих хроматограмм достаточно для обоснования
значения ПО.
- другой подход заключается в расчете ПО на основе стандартного отклонения
отклика и наклона калибровочной кривой. Стандартного отклонение определяется либо
на основании стандартного отклонения результатов многократного определения
контрольных (холостых) проб, либо на основании стандартного отклонения величин
отрезков, отсекаемых регрессионными кривыми на оси в диапазоне предполагаемого ПО.
Подобная оценка требует последующей валидации путем проведения отдельных
определений подходящего числа образцов, содержащих аналит в количестве, близком или
равном ПО:
ПО = 3ст/S, где
ст – стандартное отклонение отклика; S – наклон калибровочной кривой.
Предел количественного определения (ПКО)
минимальная концентрация, при которой аналит может бытьдостоверно количественно определен при соотношении
сигнал/шум 10:1.
При втором подходе ПКО определяют по формуле:
ПКО = 10ст/S
На ПКО методики влияют чувствительность детектора и
точность пробоподготовки при низких концентрациях примесей.
На практике ПКО должен быть ниже, чем рекомендуемый ICH
предел содержания примеси, о присутствии которой необходимо
указать в регистрационном досье.
Линейность аналитической методики
это способность (в рамках заданного диапазоне)получать результаты испытаний в виде переменных
(например, величины поглощения и площади под
кривой), прямо пропорциональных концентрации
(количеству анализируемого вещества) пробы.
Переменные, которые могут использоваться для
количественного
определения
анализируемого
вещества, - это площади пиков, высота пиков и
отношение площадей (высот) пиков анализируемого
вещества к пику внутреннего стандарта.Существует два подхода для определения линейности
методики:
- при первом непосредственно берутся различные навески
стандартного образца для приготовления растворов разной
концентрации для определения линейности. Данный метод
непригоден при приготовлении растворов с очень низкой
концентрацией из-за достаточно большой погрешности при
взвешивании;
- при втором подходе готовится исходный раствор высокой
концентрации. Линейность определяется на растворах,
полученных прямым разведением исходного стандартного
раствора. Это метод наиболее распространен и часто
рекомендуется.Следует использовать результаты определений
по крайней мере пяти концентраций.
При
нормальных
условиях
линейность
считается
приемлемой
при
коэффициента
детерминации
(квадрате
коэффициента
корреляции) > 0,997.
В соответствии с требованиями ICH также
должны быть рассчитаны наклон кривой,
остаточная сумма квадратов и величина отрезка,
отсекаемого кривой пои оси у.
Диапазон аналитической методики
интервал между максимальной и минимальнойконцентрацией анализируемого вещества в образце, для
которого
был
показан
приемлемый
уровень
прецизионности,
правильности
и
линейности
аналитической методики. Диапазон обычно выражается в
тех же единицах (например, процентах, частях на
миллион), что и результаты испытания, полученные с
помощью аналитической методики.
Для
методик
количественного
определения
фармацевтической
субстанции
или
готового
лекарственного препарата обычно рекомендуется, чтобы
диапазон составлял 80-120% номинальной концентрации.
способность
методики
оставаться
неизменной
при
небольших,
но
преднамеренных вариациях в параметрах
методики;
она
представляет
информацию
о
надежности при обычном использовании.
Робастность (устойчивость) аналитической методики
Параметры вариабельности:1. Подготовка пробы:
- время экстрагирования;
- растворитель для приготовления испытуемого раствора (рН ± 0,05 единиц, %
содержания органического растворителя ±2% (количества чистого растворителя);
- мембранные фильтры;
- стабильность испытуемого и стандартного образцов.
2. Условия высокоэффективной жидкостной хроматографии (ВЭЖХ):
- состав подвижной фазы (рН ± 0,05 единиц, % содержания органического
растворителя ±2% (количества чистого растворителя);
- используемая колонка (эквивалентные колонки, серии и/или поставщики, возраст
колонки);
- температура;
- скорость потока.
3. Условия газовой хроматографии (ГХ):
- используемая колонка (серии и/или поставщики, возраст);
- температура;
- скорость потока.
Классификация методов, используемых для фармацевтической продукции
Аналитические методы, используемые для контроля качествалекарственных средств, в общем делят на 4 класса:
- класс А – испытания, предназначенные для установления подлинности
как лекарственной субстанции, так и отдельных ингредиентов в готовом
лекарственном средстве;
- класс B – методы, предназначенные для обнаружения и
количественного определения примесей как в лекарственной
субстанции, так и в готовой
лекарственной форме;
- класс C – методы, используемые для количественного определения
лекарственной субстанции или основного ингредиента в готовом
лекарственном средстве;
- класс D – методы, используемые для оценки характеристик готовых
лекарственных средств, таких как «показатели растворимости» и
«однородность дозирования».В таблице приведены характеристики, которые учитывают для
различных классов методик, т.е. степень значимости параметров валидации
Таблица 1 – Характеристики используемые при определении различных показателей
качества лекарственных средств
Наименование
характеристик
Подлинность
Правильность
Точность
Надежность
Линейность и
Диапазон
Избирательность
Предел
Обнаружения
Предел
количественного
определения
Показатели качества
Определение Количественное Характеристика
примесей
определение
ГЛС
(растворение,
однородность,
дозировка)
+
+
+
+
+
+
+
-
+
+
+
+
+
+
+
+
Испытание
на пределы
+
+
+
+
+
-Так, например, при определении подлинности важны
способность методики определять минимальное количество
вещества и не реагировать на изменение условий и на
присутствие других компонентов в препарате, т.е. особое
значение имеют предел обнаружения, надежность и
избирательность.
При количественном определении лекарственного
вещества важна близость результатов к истинному значению,
степень разброса результатов, способность не реагировать на
изменение
условий,
давать
результаты,
прямо
пропорциональные
количеству
вещества
в
образце,
способность определять минимальные количества вещества,
т.е. важны правильность, точность, надежность, линейность и
предел обнаружения.Указанные общие правила могут иметь
исключения,
когда
характеристики,
отмеченные в таблице как не требуемые, могут
быть необходимы, и наоборот.
Кроме того, на выбор характеристики и
глубину их изучения оказывает влияние цель,
для которой заявляется методика.
Виды валидации
Валидация делится на следующие виды:- перспективная;
- сопутствующая;
- ретроспективная;
- ревалидация.
Перспективная валидация
проводится ЦЗЛ и ОКК на этапе подготовки проектаФСП на новые ЛС или при пересмотре ФСП, если
вводятся
новые
аналитические
методики.
АМ,
разработанные ЦЗЛ для проектов ФСП на ЛС,
первоначально валидируются в ЦЗЛ. Затем они
подвергаются валидационным исследованиям в ОКК для
подтверждения и сравнения результатов валидации.
При валидации каждой АМ в ОКК необходимо
повторить основную часть валидационных исследований,
используя эксперименты на точность и
правильность.
Сопутствующая валидация
проводится в ЦЗЛ и ОКК на этапе подготовкипроекта ФСП взамен существующей ФС (ВФС), если
ранее валидационные исследования для АМ,
включенных в ФС (ВФС), не проводились.
Все методы при проведении валидационных
исследований должны демонстрировать отсутствие
влияния других компонентов исследуемого образца на
результаты определения анализируемого вещества.
Ретроспективная валидация
проводится в ОКК с использованием методакарт контроля качества. Данный тип валидации
АМ используется при условии, что состав ЛС,
ведение технологического процесса и методики
контроля качества останутся неизменными.
осуществляется в ряде случаев, когда происходят
изменения в синтезе лекарственного вещества, в составе
готового ЛС и изменения в самой методике. Ревалидация
подразделяется на две категории:
- ревалидация после известного изменения, которое
может повлиять на качество продукции (включая перенос
процесса с одного предприятия на другое или с одного
участка на другой);
- периодическая ревалидация, проводимая по графику
через определенные
промежутки времени.
Ревалидация АМ (повторная валидация)
Ревалидация проводится в случае следующих изменений:а) поставщиков исходного сырья (изменение физических свойств исходного
сырья, таких как плотность, вязкость, размер частиц и др., может влиять на
механические свойства сырья и, как следствие, неблагоприятно повлиять на
процесс или целевой продукт);
б) материалов первичной упаковки (например, использование полимерных
материалов вместо стекла может потребовать внесения изменений в процесс
упаковки, использования другого оборудования, проведения изучения
стабильности и т.д.);
в) регламентирующих требований к качеству готового продукта;
г) объема серии;
д) состава готового продукта;
е) критериев оценки процесса;
ж) в ходе технологического процесса;
з) оборудования (замена оборудования и его ремонт; перепланировка и/или
ремонт производственных помещений и инженерных систем).
Ревалидация АМ (повторная валидация)
Ревалидация должна производиться также:- при появлении отклонений, выявленных при серийном выпуске
продукции;
- при переносе процесса на другое производство или на другой
участок;
- в случае неожиданных изменений, которые могут быть
выявлены при
проведении самоинспекции.
Результаты валидации оформляются протоколом о проведении
валидации.
Протокол валидации оформляется отдельно для каждого вида
аналитической методики.
Валидация производственных систем и оборудования
В последнее время стандартной практикой сталовключение процедуры «квалификация» в рамках
«Валидация». PIC/S определяет «квалификацию» как
идентификацию свойств оборудования, связанных с
выполнением особых функций, и определение
специфических пределов или ограничения данных
свойств.
Требования, предъявляемые к системам и оборудованию
- системы и оборудования подходят для намеченногоиспользования
в
соответствии
с
разработанной
документацией;
- системы и оборудования правильно установлены, в
соответствии с документацией разработки;
- системы и оборудование оснащены подходящими
инструкциями и процедурами (например, для ТО и
ремонта, калибровки, уборки), необходимыми для
выполнения работ;
- системы и оборудование работают при нормальных
условиях и при «наихудших случаях» в пределах,
указанных в документации для разработки.
До начала работ по валидации процесса необходимо завершить квалификацию критического оборудования и систем. Квалификацию обычно
проводят по следующим этапам:квалификация проекта (Design Qualification DQ) – относится к периоду до установки
оборудования. Она определяет операционные
и функциональные спецификации/требования
к оборудованию и детали обоснованного
решения в выборе поставщика.
Квалификация проекта (Design Qualification - DQ)
Этап включает в себя:- выбор поставщика, исходят из следующих
критериев: наличие в номенклатуре производства или
поставки приборов нужного типа, технический
уровень изделий и репутация поставщика на рынке,
наличие представителя в России и порядок
поддержки прибора в эксплуатации.
- выбор нужного прибора
- выбор дополнительных принадлежностей (опций).
Все это делается до принятие решения о покупке.
Квалификация монтажа (Инсталяционная квалификация – IQ)
относится у установке оборудования и определяет, что полученноеоборудование соответствует своему назначению и требованию к нему,
что оно надлежащим образом установлено в выбранной конфигурации, и
что подходит для соответствующей работы. Проводится в случаях: при
приобретении нового или бывшего в употреблении прибора,
перемещении прибора с одного места на другое в пределах предприятия.
Выполняется, когда прибор доставлен к месту эксплуатации. При этом:
- проверяется соответствие поставленного оборудования заказу и
комплектность поставки, включая документацию;
- готовится место для установки оборудования (то, что оборудование
может быть размещено на выделенном для него месте, должно быть
проверено при его заказе);
- проверяется подвод необходимых коммуникаций (электроэнергии,
воды, сжатого воздуха и пр.).
Квалификация функционирования (Операционная квалификация – OQ)
процесс,показывающий,
что
оборудование
будет
функционировать согласно рабочим/операционным требованиям к
нему в выбранной конфигурации. Валидациия OQ проводится при
условии успешного завершения валидации оборудования IQ. Она
может полностью или частично совмещаться с IQ исходя из
конкретной обстановки. В перечень работ могут входить: распаковка,
сборка и установка оборудования, на предназначенного для него
место в соответствии с требованиями изготовителя (выполняется
представителя
завода-изготовителя,
специализированной
организацией или пользователем при наличии необходимой
подготовки); проверка фиксированных (неизменяемых) параметров
прибора, программного обеспечения и функциональные проверки
(проводятся по инструкции завода-изготовителя).
Квалификация эксплуатации (Эксплуатационная квалификация – PQ)
процесс, показывающий, что оборудованиепостоянно эксплуатируется в соответствии со
спецификацией – условиями, подходящими для его
рутинного использования. Валидация PQ проводится
при условии успешного завершения IQ и OQ. Она
предназначена для подтверждения правильной работы
прибора в условиях эксплуатации. В состав работ
могут входить тесты по проверке работоспособности
с использованием контрольных тестов, тесты по OQ,
но в расширенном диапазоне пр.В
дальнейшем,
при
эксплуатации,
проверка
работоспособности
выполняется
по
инструкции
изготовителя с определенной периодичностью. Возможны
разные варианты, например, проверка перед каждым
использованием, если это необходимо. Пользователь
должен
вести
архив
данных
о
проверках
работоспособности прибора и его работе, которые могут
служить основанием для подтверждения правильности
определения периодичности проверок.
После полной квалификации оборудования мы можем
переходить к валидации аналитических методов.
1. На фармацевтическом предприятии должен быть
определен сотрудник, ответственный за проведение валидации,
который формирует рабочую группу и назначает ее
руководителя. Руководитель рабочей группы составляет план
проведения валидации с максимальным учетом накопленной
ранее информации.
План должен быть согласован всеми заинтересованными
подразделениями (проектные, конструкторские, научноисследовательские, производственные, по контролю за
качеством) и утвержден сотрудником, ответственным за
проведение валидации.
2. Рабочая группа и представители заинтересованных
подразделений, выполняющие работу по валидации, несут
ответственность за ее проведение в соответствии с планом.
Обработка и оформление результатов валидации
3. Персонал, привлекаемый к работе по проведениювалидации, должен пройти соответствующее обучение
(инструктаж).
4. Отчет о проведении валидации должен содержать:
-цель;
- исходную информацию;
- сведения о калибровке измерительных средств;
- протоколы полученных результатов по проверке соответствия
монтажа, работоспособности оборудования и условий и
параметров технологического процесса спецификациям и
нормативной документации;
- анализ полученных результатов, предложения и выводы;
- требования по проведению повторной проверки.
Обработка и оформление результатов валидации
На основании полученных результатовруководитель рабочей группы составляет отчет о
проведении валидации.
Сотрудник, ответственный за проведение
валидации, утверждает отчет и выдает
заключение
о
соответствии
объекта
(оборудование, технологический процесс и т.д.)
требованиям
нормативной
и/или
технологической документации.
Примерное содержание отчета о проведении валидации (Рекомендуемое)
1. Объект валидации и его идентификация, дата (период) и место проведения.2. Цель и вид валидации.
3. Идентификация валидаторов (ФИО, должность, подпись, дата);
4. Исходная информация:
4.1. Общая характеристика объекта, включая критические параметры.
4.2. Перечень документации (регламенты, фарм.статьи, проектная документации, инструкции,
спецификации, сертификаты, паспорта и др.).
4.3. Перечень методик проведения испытаний (измерений, отбора проб и др.) и критериев оценки
результатов.
4.4. Сведения о привлеченных организациях или экспертах.
5. Сведения о калибровке/поверке:
5.1. Средств измерений (приборы, датчики, весы и др.), установленных в оборудовании, инженерных
системах, помещениях и др.
5.2. Средств измерений, используемых при проведении валидации/ квалификации.
6. Документы:
6.1. Валидационные протоколы всех стадий квалификации (DQ,IQ,OQ,PQ) и валидации процессов (PV),
или ссылка на них с указанием места хранения.
6.2. Протоколы (отчеты и др.) с данными и результатами испытаний, отбора проб и т.п.
7. Анализ полученных результатов, в т.ч. по:
7.1. Проверке критических условий и параметров.
7.2. Выявленным отклонениям (изменениям), требующим действий по корректировке.
7.3. Условиям охраны труда и технике безопасности.
8. Вывод по результатам валидации.
9. Сроки проведения повторной плановой валидации.
Здравствуйте, уважаемые читатели блога сайт. Слова валидация и верификация пришли в русский язык относительно недавно (в отличии, например, или ) вместе с международными стандартами разработки и приемки продуктов и технологий. В связи с этим, как обычно, возникает некоторая путаница с переводом технических терминов на русский язык и их трактовкой.
Кроме непосредственно технологических процессов, слова верификация и валидация активно используются в интернете , например, при регистрации в платежных системах ( , и др.), где для привязки к аккаунту пластиковой карты бывает необходимо пройти процесс ее верификации (проверки). Владельцы же сайтов знают, что в специальном сервисе на соответствие требованиям.
Также вас может интересовать значение слова валидация в связи с тем, чтоб при входе в Контакте, Мой Мир или Однокласники у вас выскакивает окно с требованием пройти валидацию вашего аккаунта с помощью ввода номера телефона или отправки СМС. Как правило, это результат действия вируса заразившего ваш компьютер, поэтому чуть ниже мы и этой коснемся, а также вариантов ее решения.
Что такое верификация и чем она отличается от валидации?
Давайте я попробую объяснить простыми словами изначально заложенный в эти слова смысл, ибо тот технический перевод, что вы можете найти, например, в Википедии (верификация и валидация) мало на что годится, если вы не специалист в этой области и с подобным никогда не сталкивались.
Итак, что же такое это за слова такие хитрые? Как я уже говорил, прямой перевод толкования терминов приводит к тому, что валидация и верификация кажутся нам словами синонимами и означают проверку (собственно, на бытовом уровне это зачастую так и бывает). Однако, разница между ними есть, причем кардинальная.
Давайте для общего развития я попробую пояснить разницу. Слово верификация (от английского verification) означает проверку или тестирование. Какой бы технологический процесс не взять (изготовление механического изделия, написание программного обеспечения и т.п.), то верификация будет означать проверку правильности и качества выполнения всех этапов изготовления. Если собирали велосипед, то проверятся наличие всех необходимых элементов (руля, педалей, рамы и т.д) и соответствие их указанным в техзадании параметрам качества.
Слово валидация (от английского validation) ближе всего к понятию аттестация, а по сути означает комплексную проверку изделия требованиям заказчика им же самим. Если собирали велосипед, то он будет валидирован после того, как на нем прокатятся представители заказчика и признают его удовлетворяющим своим «хотелкам».
В чем же отличие ? Можно сказать, что валидация — это тестирование изделия на физическую функциональность в процессе передачи его заказчику (велосипед едет или нет — проводят испытания) , а верификация — это то же тестирование, но «бумажное» на предмет соответствия изделия техническому заданию (как раз то самое наличие педалей, колес и руля у велосипеда), и проводится оно еще до передачи изделия или программного продукта заказчику.
Это безусловно грубое упрощение, но зато позволяющее пояснить разницу между понятиями простыми и доступными всем словами.
Еще один «грубый» пример . Допустим, было разработано новое лекарственное средство. Его формула и ТЗ передаются на фабрику. Исполнитель по окончанию работ проверяет (верифицирует) его химический состав и качество на соответствие ТЗ (техзадания). Заказчик же проводит валидацию полученного лекарства, испытывая его действие на пациентах или мышах. Если желаемый эффект будет достигнут, а побочные действия окажутся в рамках прогнозов, то лекарство будет успешно валидировано (аттестовано).
То же самое касается и программного обеспечения. Исполнитель выполняет работу, проводит верификацию на предмет соответствия функционала ПО техзаданию, а вот уже заказчик ставит ПО у себя и смотрит — выполняет ли оно возложенную на него задачу или нет. От результатов будет зависеть и решение по валидации или отправке на доработку.
Другими словами . Верификация — это подтверждение того, что задание было выполнено в полном соответствии с требованиями заказчика. А валидация — это проверка того, так ли как надо результирующее изделие (продукт) функционирует на практике. Может возникнуть ситуация, когда ТЗ выполнено, а изделие не работает или работает не так как надо. Поэтому процесс валидации является более всеобъемлющим и показательным, чем верификации (штамп «валидировано» ставится поверх штампа «верифицировано», если так можно выразиться).
Валидация и верификация в онлайн-сервисах интернета?
Скорее всего приведенные выше объяснения вас глубоко не тронули, ибо вам узнать значение этих слов нужно было совсем по другой причине (вне рамок отношений заказчик — исполнитель). Дайте догадаюсь почему?
Ну, возможно, вы вирус цепанули на комп и вас теперь в какую-нибудь социальную сеть всплывающее окно «Пройдите валидацию» не пускает. Вы смутно догадываетесь, что сообщать свой номер телефона или отправлять СМС не является лучшим решением проблемы, поэтому и на тему «что такое валидация». Заранее скажу, что отправлять ничего не нужно, а нужно комп чистить и файл Хостс приводить в исходный вид. Об этом чуть ниже мы поговорим подробнее.
Также, возможно, что вы зарегистрировались в какой-нибудь платежной системе (или другом онлайн-сервисе), где предлагают верифицировать вашу платежную карту, валидировать сайт или сделать что-то подобное. Буржуйские термины вам показались не слишком понятными и вы .

В этом случае опасаться нечего. Вас могут, например, при попытке привязки карты к аккаунту платежной системы, попросить верифицировать свою кредитку (проверить ее на способность проведения платежей). Обычно с нее снимают небольшую сумму, а потом просят вас указать, а сколько именно было снято. Если указали, то карта верифицируется и ей можно будет пользоваться для пополнения виртуального счета или вывода с него средств.
Слово верификация тут используется по прямому назначению, т.е. как синоним слова проверка или тестирование. Так как многие сервисы в рунете создаются по образу и подобию ранее созданных платежных систем буржунета, то и терминология зачастую заимствуется тоже оттуда. В общем, тут вам предлагают просто потетстить карточку на предмет работоспособности перед началом ее использования.
Некоторые сервисы предлагают пройти процедуру валидации , т.е. аттестации (подтверждения) вашего аккаунта, чтобы получить больше возможностей и прав. Выражается это обычно в подтверждении своей личности (нужно прислать скан паспорта; либо с экраном компа, где открыта страница сервиса; либо указать номер телефона и потом ввести код полученный через СМС). Все это довольно часто владельцы сервисов обзывают валидацией, ибо слово получило достаточно большое распространение и стало можно сказать «модным».
Например, в Яндекс Деньгах мне пришлось пройти процесс валидации (идентификации) для того, чтобы получить возможность принимать платежи с некоторых сервисов на свой кошелек. Пришлось показать паспорт и стать своего рода аттестованным пользователем системы. Во многих социальных сетях просят указать номер своего мобильного телефона, а потом пройти процесс его валидации/верификации (проверки) путем отправки на него СМС с кодом, который нужно будет ввести в специальном поле на странице регистрации.
Валидация аккаунта Вконтатке и Одноклассниках — у вас вирус
Последнее время довольно распространен вирус , который при входе на сайты популярных социальных сетей (Вконтакте, Одноклассники, Мой мир и др.) выбрасывает табличку с сообщением, что ваш аккаунт должен пройти валидацию описанным способом.

Это мошенники. Очень ненавязчиво и требовательно они вытянут из вас деньги (платные СМС сообщения и т.п. вещи), заставят установить какую-нибудь гадость на свой компьютер или сделают еще что-то не очень приятное. Что же делать?
Во-первых, не вестись на все эти уловки. Кто вас попросил о валидации — администрация социальной сети или злоумышленник, который с помощью вируса подменил страницу социальной сети? Как проверить ? Довольно просто.
- Посмотрите на адресную строку в вашем браузере — точно ли там написан адрес соцсети, а не поддельного сайта. Если адрес не тот (какая-то буква заменена или другой обнаружили), то просто откройте страницу соцсети в новой вкладке из закладок барузера или же набрав ее название в Яндексе (Гугле), а затем перейдя по первой приведенной ссылке (это будет ).
- Если адрес верный, то попробуйте войти в свой аккаунт Вконтакте или Одноклассников с другого компьютера (планшета, сотового телефона). Можно попробовать также и с этого же компа. Войти получилось? Валидации не требовали ? Значит ваш компьютер заражен вирусом и его нужно срочно лечить.
Во-вторых, нужно начать искать способ удаления вируса или хотя бы на первых порах нейтрализации его последствий. Если у вас антивирус не стоит, или он не активен (не оплатили очередной период, не обновили антивирусные базу, его заблокировал вирус), то попробуйте скачать портативную и бесплатную версию Доктора Веба (доверяю ему уже больше десяти лет) и просто запустите быструю проверку.

Наверняка он скажет, что у вас изменен файл Hosts и предложит его починить. После этого при входе в Контакт, Одноклассники и другие сети у вас валидацию требовать уже не будут.
Если данная утилита по каким-то причинам вам не помогла (не получилось скачать, не запустилась и т.п.), то можно самому попробовать найти и почистить от лишних записей так называемый файл Hosts .
Дело в том, что вирус мог в нем прописать строчку с адресом соцсети и совершенно не относящимся к ней IP-адресом. Браузер всегда сначала обращается к файлу Хостс на вашем компе (а только потом в интернет), и если там находит соответствие IP адреса и домена (например, vk.com 109.121.92.15), то сайт соцсети он будет открывать именно с этого IP, а там уже будет подготовлен фейковый сайт как две капли воды похожий на настоящий, но который при попытке входа будет выкидывать сообщение о валидации.
Если ничего из вышенаписанного вам не помогло, то пробуйте другие антивирусы или можете восстановить свою операционную из образа, если его раньше делали к примеру с помощью Акрониса. В худшем случае вам придется либо нести комп к специалисту, либо самостоятельно винду переустанавливать, а в дальнейшем быть максимально осторожным и обязательно пользоваться антиирусом, чтобы никаких табличек с валидацией более не выскакивало.
Удачи вам! До скорых встреч на страницах блога сайт
Вам может быть интересно
 Ликбез - что это такое (значение слова)
VirusTotal - онлайн проверка на вирусы файлов вашего компьютера, телефона и сайтов всеми антивирусами одновременно
Ликбез - что это такое (значение слова)
VirusTotal - онлайн проверка на вирусы файлов вашего компьютера, телефона и сайтов всеми антивирусами одновременно
 Аутсорсинг - что это такое простыми словами
Аутсорсинг - что это такое простыми словами
 Контекст - что это такое?
Гомеопатия - это безобидные лекарства или же вред для здоровья
Что такое жизнь - определение и 4 главных этапа жизни человека
Как бесплатно установить Гугл Хром, Яндекс Браузер, Оперу, Мазилу и Интернет Эксплорер на свой компьютер
Сепсис - что это такое, откуда берется болезнь, каковы симптомы и признаки сепсиса
Волчанка - что это за болезнь, каковы ее симптомы и прогнозы на успешное лечение
Что такое толерантность
Контекст - что это такое?
Гомеопатия - это безобидные лекарства или же вред для здоровья
Что такое жизнь - определение и 4 главных этапа жизни человека
Как бесплатно установить Гугл Хром, Яндекс Браузер, Оперу, Мазилу и Интернет Эксплорер на свой компьютер
Сепсис - что это такое, откуда берется болезнь, каковы симптомы и признаки сепсиса
Волчанка - что это за болезнь, каковы ее симптомы и прогнозы на успешное лечение
Что такое толерантность
— придание законной силы, утверждение, легализация, ратификация
(общегражданское право);
— процесс, позволяющий определить, насколько точно с позиций потенциального пользователя некоторая модель представляет заданные сущности реального мира
(системное программирование);
— процедура, дающая высокую степень уверенности в том, что конкретный процесс, метод или система будет последовательно приводить к результатам, отвечающим заранее установленным критериям приемлемости; в частности, валидация технологических процессов проводится с использованием образцов не менее трех серий реального продукта с целью доказательство и предоставление документального свидетельства, что процесс (в пределах установленных параметров) обладает повторяемостью и приводит к ожидаемым результатам при производстве полупродукта или готового продукта требуемого качества; валидация аналитических методов состоит в определении: точности, воспроизводимости, чувствительности, устойчивости (межлабораторная воспроизводимость), линейности и других метрологических характеристик
(GMP — Надлежащая производственная практика, является обязательным требованием при производстве лекарственных средств).
Применительно к системам менеджмента качества согласно стандартам ISO серии 9000:
Валидация
— подтверждение на основе представления объективных свидетельств того, что требования, предназначенные для конкретного использования или применения, выполнены
(ISO 9000:2005)
Валидация
— подтверждение путем экспертизы и представления объективного доказательства того, что особые требования, предназначенные для конкретного применения, соблюдены.
Примечания:
- При проектировании и разработке утверждение означает проведение экспертизы продукции с целью определения соответствия нуждам потребителя.
- Утверждение обычно осуществляется на конечной продукции в определенных условиях эксплуатации. Оно может быть необходимо на более ранних стадиях.
- Термин «утверждено» используется для обозначения соответствующего статуса.
- Могут осуществляться многократные утверждения, если предполагается различное использование.
(ISO 8402:1994, п.2.18)
По определению PIC/S, это:
«Действия, которые в соответствии с принципами GMP доказывают, что определенная методика, процесс, оборудование, сырье, деятельность или система действительно приводят к ожидаемым результатам».
Валидация
Исследования по валидации должны способствовать надлежащей практике производства; их следует проводить в соответствии с установленными процедурами. Результаты и заключения должны быть оформлены протоколами.
Если вводят новую производственную рецептуру или новый способ изготовления, то должны быть предприняты действия, демонстрирующие их пригодность для серийного производства. Должно быть доказано, что установленный процесс при использовании специфицированных веществ и оборудования позволяет постоянно получать продукцию требуемого качества.
Существенные изменения производственного процесса, включая любое изменение оборудования или материалов, которое может повлиять на качество продукции и/или воспроизводимость процесса, должны пройти валидацию.
Процессы и процедуры следует подвергать периодической критической ревалидации, чтобы гарантировать, что они по-прежнему способны приводить к ожидаемым результатам.
Валидация и ее документирование
Цель валидации простая: доказать, что объект валидации действительно приводит к ожидаемым результатам. Другими словами, валидация должна показать, что производитель полностью управляет процессом производства. Валидация является интегральной частью «обеспечения качества», показывая, что производитель понимает причины изменчивости процесса и, главным образом, понимает какие параметры необходимо контролировать для обеспечения стабильности процесса. Эффективная валидация основана на менеджменте риска и современном уровне науки.
Процедуры процесса валидации должны быть зафиксированы в ряде протоколов и результаты валидации должны быть зафиксированы в записях или отчетах.
Эти документы используются в разных формах при получении регистрационного удостоверения и инспекции в соответствии с правилами GMP и так же, для внутренних производственных целей, чтобы руководство организации могло быть уверено в том, что оно контролирует свои процессы. Документация процесса валидации является базой для необходимой регуляции. Но для того, чтобы избежать
той ошибки, которая часто встречается при внедрении принципов GMP в России, мы сознательно обсуждаем процесс документирования валидации в разделе о документации.
Существует довольно серьезная разница между российским и международным подходами. В российских правилах GMP, валидация «заключается в документированном подтверждении соответствия оборудования, условий производства, качества сырья и готового продукта действующим регламентам и\или требованиям нормативной документации». Это подход – устаревший. Его последствия – довольно вредные. Из разных публикаций может создаться впечатление, что процесс валидации является не более, чем процессом документирования или, что такие слова как «валидация» «верификация», «квалификация» и «испытание», в самом деле, являются аналогами друг друга. Отсутствие понимания «валидации» укрепляет недопонимание GMP, и создает ситуацию, когда персонал сопротивляется внедрению GMP, просто принимая его как «вечно растущую гору документов».
В GMP EC (и, кстати, GMP FDA) валидация является регулярным изучением систем, процессов, инженерных комплексов и, естественно, самого фармацевтического продукта, чтобы обеспечить высокий уровень уверенности в том, что процессы были должным образом разработаны и находятся под контролем.
Эффективная валидация требует использования подхода, основанного на управлении рисками, полного понимания процессов производства и повышения их устойчивости, посредством внедрения новых технологий. Таким образом, валидация является динамическим процессом. Этот факт, очевидно, представляет некоторые сложности для регуляторных органов.
С точки зрении разработчиков и производителей ЛС валидация способна обеспечить следующие преимущества:
- более глубокое понимание процессов и поэтому, уменьшение риска при предотвращении проблем и обеспечение гладкого управления процессом;
- снижение стоимости устранения недостатков;
- уменьшение риска несоответствия требованиям регуляторных органов.
После полной валидации процесса, возможно, что количество контролируемых параметров в конце процесса уменьшится. Разработчики, полностью понимая те параметры, которые влияют на изменчивость и, следовательно, на стабильность процесса, имеют необходимую информацию для управления процессом, например, через снижение изменчивости или повышение его скорости. Хотя «валидация» является интегральной частью «обеспечения качества», здесь видна взаимосвязь между валидацией и системой менеджмента. Для того чтобы эффективно проводить валидацию, руководство компании должно определить свою политику в данном вопросе. Одним из первых элементов, который инспектор FDA или PIC/S на-мерен проверить, является именно политика валидации.
Тезисы доклада для 13-го международного проекта "Созвездие качества"2012"
Сложности интерпретации требований ИСО 9001 в отношении «валидации специальных процессов» известны каждому менеджеру по качеству, который хоть раз сталкивался с внедрением этого стандарта. Вот и получается на практике, что вполне стандартное требование, четко и подробно описанное в нормативных документах для фармацевтической отрасли, для других отраслей сопровождается пугающим количеством толкований и разъяснений. Выдержка из ИСО 9001, пункт 7.5.2: «Организации следует осуществлять валидацию любого процесса выпуска продукции или предоставления услуг, подтверждение (верификацию) конечного выхода которого невозможно провести последующим мониторингом или измерениями, и следовательно, недостатки которого (т.е. конечного выхода) выявляются только после начала использования продукта или завершения оказания услуги». И соответственно в стандарте ИСО 9000:2005 в 3-м примечании к определению термина «процесс» (3.4.1) указано, что «Процесс, в котором подтверждение (верификация) соответствия конечной продукции не может быть проведено своевременно или влечет к значительным экономическим затратам, часто называют специальным».
Для фармацевтической отрасли под определение специального процесса полностью подпадает «технологический процесс», т.е. процесс изготовления лекарственного препарата. Естественно предполагается, что препарат качественный. Что такое «качество лекарственного препарата»? Прежде всего, это его эффективность, безопасность и соответствие спецификации (стандарту качества). Соответствие спецификации можно подтвердить контролем качества (по сути, верификацией), однако проблема в том, что контроль выборочный. Т.е. результаты контроля распространяются на всю серию на основании тестирования образцов, которые не идут в продажу. И это еще большая задача, доказать что выборка – репрезентативна. Дальше еще хуже. Безопасность и эффективность лекарственного препарата подтверждаются (или не подтверждаются) только в процессе его применения– т.е. тогда, когда что-то изменить, исправить уже невозможно.
Именно поэтому одним из ключевых принципов GMP (GoodManufacturingPractice, Надлежащая производственная практика) считается валидация технологического процесса. Валидации процессов посвящено отдельное приложение – Приложение 15 GMP, которое было включено в GMP в 1987 году. И что очень важно, без результатов валидации коммерческий выпуск лекарственного препарата невозможен, правильнее сказать жестче – запрещен. Валидация поддерживает концепцию GMP в переносе центра тяжести с контроля качества готового продукта на обеспечение качества процесса. Кроме того, процедуры организации и проведения валидации отражают базовые принципы GMP, а именно: продуманное планирование, четкое выполнение и подробное документирование. Валидация включает такие важные для GMP элементы, как научный подход на основе оценки рисков по качеству и управление изменениями.
Что такое валидация?
Корень «валид» означает пригодный. В русском языке есть несколько слов с этим корнем, например «инвалид» - непригодный, «валидный» - пригодный. В фармацевтической отрасли, термин «валидация» трактуется следующим образом: «Процесс документированного подтверждения достижения разумной степени уверенности в том, что
- Производственный процесс,
- Аналитические методики,
- Используемое оборудование,
- Производственные системы, соответствуют действующим принципам GMP и выполняют свое функциональное назначение, т.е. их использование действительно дает ожидаемые результаты».
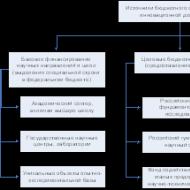
По сути, валидация технологического процесса – это конечная цель, для достижения которой нужно последовательно провести валидацию ряда других связанных процессов. В GMP общий термин «валидация» разделяется на два понятия: «валидация процессов» и «квалификация производственных систем». Квалификация производственных систем – это часть валидации процесса, направленная на документальное подтверждение пригодности оборудования, инженерных систем, комплекса помещений, которые используются в производстве лекарственного препарата. Квалификация проводится для того, чтобы быть уверенными в том, что производственная система не влияет на качество продукта, а также для того, что если мы в ходе непосредственно валидации технологического процесса получим негативный результат – это не может быть связано с отказами оборудования/систем, а причины нужно искать в самом технологическом процессе). По своей логике, квалификация производственных систем – это некая предупреждающая мера.
Таким образом, под валидацией процесса в фармацевтической отрасли подразумевается* :
- Квалификация чистых помещений
- Квалификация инженерных систем (подготовка чистого воздуха, воды очищенной и воды для инъекций, сжатого воздуха и т.п.)
- Квалификация производственного оборудования
- Квалификация аналитического оборудования (используемого для контроля качества сырья, полупродуктов и готовой продукции)
- Квалификация складских зон (сырье, готовая продукция)
- Валидация компьютеризированных систем, включая квалификацию ИТ-инфраструктуры
- Верификация фармакопейных методик (методики, внесенные в национальную или региональные Фармакопеи)
- Валидация очистки помещений, оборудования
- Валидация этапов технологического процесса
- Валидация упаковки
Организация валидационных работ
Ответственность за проведение валидационныхработ как правило возложена на Отдел обеспечения качества. Для координации деятельности структурных подразделений создается Валидационная комиссия и валидационные группы.
Документальное сопровождение
Стандартный пакет валидационной документации:
- Валидационный мастер-план (или Общий план валидации)
- Валидационное досье (отдельно для каждого объекта):
- Спецификация требований пользователя (URS, User Requirement Specification)
- Протокол оценки рисков
- Программа (сценарий) валидационных работ
- Протокол/Отчет валидационных работ
- Программа (плановой, внеплановой) ревалидации (повторной валидации)
Квалификация
Для каждого критического объекта инфраструктуры должна быть проведена квалификация, которая, как правило, осуществляется в четыре последовательных этапа:
- Квалификация проекта (DQ, Design Qualification)
- Квалификациямонтажа(IQ, Installation Qualification)
- Квалификация функционирования (OQ, Operational Qualification)
- Квалификациявэксплуатации(PQ, Performance Qualification)
Квалификация проекта (DQ) направлена на документированное подтверждение пригодности проекта (конструкции, проектного решения) технических средств, инженерных систем и оборудования для их предполагаемого использования. Объем работ на этом этапе:
- Описание системы (функция, параметры оборудования, особые характеристики)
- Техническая документация (нормативные требования, документация по оборудованию)
- Оценка конструкции (конструкционные материалы, оценка риска загрязнений)
- Компоненты/элементы оборудования/системы
- Анализ возможных отказов/дефектов
- Анализ способа изготовления (критические параметры работ при изготовлении оборудования, требования по калибровке)
Квалификация монтажа (IQ) направлена на документированное подтверждение того, что технические средства, инженерные системы и оборудование сконструированы, оснащены и смонтированы в соответствии с рабочей документацией проекта и рекомендациями производителя. Объем работ на этом этапе:
- Наличие достаточной документации
- Наличие всех элементов в поставке
- Правильность монтажа и подключений
- Соответствие контактирующих материалов
- Соответствие средств измерений
Квалификация функционирования (OQ) направлена на документированное подтверждение того, что технические средства, инженерные системы и оборудование функционируют должным образом по всему заявленному диапазону рабочих характеристик. Объем работ на этом этапе:
- Приемлемость документации (инструкции по эксплуатации, обслуживанию);
- Испытания, включающие условие или ряд условий, охватывающих верхний и нижний пределы рабочих параметров:
- Срабатывание блокировок/сигнализаций.
Как правило, после этого этапа квалификации объект вводится в эксплуатацию.
Квалификация функционирования (PQ) проводится для инженерных систем, которые работают непрерывно, а также для оборудования со сложным управлением.Квалификация в эксплуатации – это документированное подтверждение того, что технические средства, инженерные системы и оборудование при совместном (или длительном) использовании могут надежно функционировать с получением воспроизводимых свойств продукта.
При этом, если производственная система оснащена автоматизированной системой мониторинга параметров, или обработки данных, дополнительно должна проводиться валидация компьютеризированной системы.
Валидация аналитических методик
Каждая аналитическая и микробиологическая методика, которая используется для контроля качества сырья, полупродукта или готового продукта должна пройти валидацию. Это означает, что мы обязаны получить доказательства пригодности такой методики для контроля конкретного продукта и соответственно, гарантии получения достоверных результатов. В этом плане, требования GMP полностью совпадают с требованиями ИСО 17025.
Валидация очистки
Процедуры очистки оборудования должны также пройти валидацию до того, как мы приступим к производству препарата на этом оборудовании. Прежде всего, эта валидация направлена на получение гарантий возможности проведения качественной очистки после изготовления такого продукта. По сути, это минимизация риска перекрестного загрязнения при переходе на производство другого продукта на этом же оборудовании. Если на оборудовании останутся остатки предыдущего продукта, это не будет обнаружено – так как отсутствует аналитический контроль именно на наличие таких примесей.
Валидация асептических условий
При производстве стерильных лекарственных средств с использованием асептических технологий до начала самого технологического процесса необходимо подтвердить, что на всем протяжении процесса изготовления препарата (т.е. длительность процесса), в продукт не попадает ни один микроорганизм. Валидация асептических условий проводится по сценарию имитации с помощью питательных сред.
Валидация технологического процесса
И непосредственно, валидация каждого из этапов технологического процесса проводится на 3-х последовательных сериях с учетом «наихудшего случая». И, что очень важно, валидациятехнологического процесса проводится отдельно для каждого продукта и его заявляемого размера серии. Наихудший случай – это проведение процесса при таких условиях и обстоятельствах (для параметров процесса, режимов работы оборудования), которые имеют максимальные шансы вызвать отклонение процесса или несоответствие продукта по сравнению с идеальными условиями. Логика очень проста – если при таких условиях мы получаем качественный продукт, значит, гарантированно мы будем достигать качества внутри заданных диапазонов.
Повторная валидация/квалификация
Через заданные периоды эксплуатации (использования), каждый объект/процесс должны пройти повторнуювалидацию. Основная цель повторной валидации (ревалидации) – это получить подтверждения того, что объект/процесс продолжает находиться в валидном состоянии.Это полностью отражает логику GMP: «Для подтверждения качества продукта недостаточно провести валидацию в начале его жизненного цикла, необходимо обеспечить мониторинг и постоянное улучшение» (см. схему ниже).
- 09.08.2019
«Аналитика Экспо 2020»
Единственная в России выставка лабораторного оборудования и химических реактивов
«Аналитика Экспо 2020»
21 - 24 апреля в Москве, МВЦ «Крокус Экспо»
Продемонстрируйте свою продукцию потенциальным клиентам – посетителям выставки.Участие в выставке «Аналитика Экспо» позволит вашей компании:
- Привлечь новых клиентов
- Увеличить объемы продаж
- Расширить географию сбыта
«Аналитика Экспо» - главное событие в области аналитической химии в России и странах СНГ.
Выставка является центральной бизнес-площадкой, объединяющей поставщиков аналитического
оборудования и специалистов различных научных и производственных лабораторий.Посетители выставки «Аналитика Экспо» - это специалисты российских научных
и производственных лабораторий из различных отраслей промышленности: химической,
фармацевтической, пищевой, медицинской, нефтегазовой, строительной, экологической,
металлургической и других, а также научно-исследовательских организаций, здравоохранения
и государственных учреждений.Ежегодно выставка показывает рост посетителей - в 2019 году 50% специалистов
присутствовали на выставке впервые.Более 240 компаний , ведущих отечественных и зарубежных производителей и поставщиков,
ежегодно принимают участие в выставке «Аналитика Экспо». Сейчас идет активный процесс
бронирования площади на 2020 год.Успейте забронировать стенд на выставке «Аналитика Экспо 2020»!



- 05.08.2019
Соблюдение температурного режима – камень преткновения для участников товаропроводящей цепи
Количество судебных споров, связанных с термолабильностью лекарств, увеличивается. Об этом в ходе круглого стола «Валидация процесса транспортировки лекарственных средств», организованным Советом профессионалов по цепям поставок, заявил руководитель практики «Здравоохранение» юридической фирмы «Пепеляев групп» Александр Панов.Мероприятие состоялось в рамках третьей встречи рабочей группы «Фармацевтическая логистика» и собрало руководителей логистических компаний, а также представителей фармпроизводителей и дистрибьюторов.
Руководитель ГК «Виалек» Александр Александров, обратил внимание, что отклонения в температурном режиме далеко не всегда приводят к несоответствию продукта должному уровню качества. По его словам, перевозки без отклонений не бывает, о чем свидетельствует, в том числе, и зарубежный опыт.
«Невозможно обеспечить, чтобы температурный режим ни на минуту не вышел за пределы, - подчеркнул он. - Другой вопрос в том, что мы не должны допускать долгосрочных отклонений, и с юридической точки зрения это еще предстоит доработать, потому что сейчас в этом вопросе зачастую ставят знак равенства». Еще одна распространенная ошибка – мерить температуру воздуха, а не температуру продукта при перевозке, добавил он.
Продолжая тему неточностей в определениях, эксперт отметил, что за качество продукции отвечает производитель и держатель регистрационного удостоверения. И в этой связи не нужно манипулировать понятиями «эффективность и безопасность».
«Безопасность и эффективность подтверждаются на этапе доклинических и клинических исследований, - напомнил он. - Логисты обеспечивают это через применение надлежащих практик. Но говорить, что при перевозке нужно обеспечить безопасность и эффективность препарата, некорректно - перевозчики должны гарантировать, что транспортировка товара не оказала никакого влияния на качество продукта».
Подробности читайте в «ФВ» № 23 (978) от 23.07.2019 г. в публикации «Как повезет».
Актуальность темы валидации процессов производства и предоставления услуг в рамках выполнения требований стандарта ISO 9001 не вызывает ни у кого сомнений. Однако все организации, внедряющие системы менеджмента качества (СМК), неизбежно сталкиваются с многочисленными вопросами; Что такое "валидация"? Есть ли в организации процессы, подлежащие валидации? Что это за процессы? Что необходимо сделать для того, чтобы подтвердить проведение валидации? Что такое специальные процессы? Каковы критерии [отнесения процессов к специальным?] И много-много других вопросов, адресованных консультантам и собственным специалистам организаций.
Консультанты и специалисты предприятий, вооруженные теоретическими и практическими знаниями, рассказывают владельцам и участникам процессов, высшему руководству увлекательные истории о назначении комиссии по валидации, графиках и актах валидации специальных процессов (почему-то только специальных процессов), о возможной разработке документированной процедуры на эту тему. Эти истории с завидным постоянством повторяются в учебных пособиях, лекционных материалах (включая программу МВА). И если рассказы о валидации, включающей анализ применяемых материалов и комплектующих, технологического, измерительного и контрольного оборудования, несоответствующей продукции, претензий потребителя, обеспеченности и компетентности персонала, записей, технологической документации, результатов мониторинга технологических операций и т. п. еще как-то воспринимаются, то рассказы о специальных процессах вызывают по большей части недоумение и непонимание. Ответственные за процессы делают вывод, что надо разработать очередной документ, вероятно, нужный, но очень объемный, и не совсем понятный. На каких только примеpax не объяснялась валидация специальных процессов: "на конфетах и ракетах", покраска стен и поклейка обоев, изготовление металлоконструкций и выпечка хлеба! Итогом всегда являлось то, что... "вот приедут аудиторы, а организация не предоставит ни одного акта валидации! Вот оно, значительное несоответствие! Вот оно, невыполнение требований стандарта!". Конечно, к приезду аудиторов готовятся акты валидации или документированные обоснования отсутствия специальных процессов. Работа проведена, результат может быть продемонстрирован, но проблема-то в понимании сути происходящего осталась!
Проблема, на наш взгляд, состоит в том, что эквивалент термина "валидация" в русском языке отсутствует (см. ГОСТ Р ИСО 9001, р. 3). В ГОСТ Р ИСО 9001 применен термин "подтверждать", а в различных вариантах переводов стандарта ISO 9001 используются термины "подтверждать", "валидировать", хотя с таким же основанием могли быть применены термины "утверждать", "ратифицировать", "легализовать", "придавать законную силу" и т. п. О фактическом значении термина пришлось догадываться! В любом случае все последующие действия, связанные с выполнением так и непонятого требования, строятся на том устоявшемся понимании, которое предполагает алгоритм действий: приказ о назначении комиссии по валидации - график/план валидации специальных процессов - акт валидации специальных процессов. И это устоявшееся понимание практически узаконило эти (или подобные) документы для СМК организации!
Требования, устанавливаемые стандартом ISO 9001 к СМК организаций, постоянно подвергаются анализу. На его основе приходит осознание необходимых действий. По нашему мнению, до осознания термина "валидация" необходимо выполнить еще пару шагов! И мы, не претендуя на истину в последней инстанции, представляем свой взгляд на решение существующей проблемы, и предлагаем вместе с нами сделать эти два шага.
Шаг 1. Определить процессы организации, подлежащие валидации. В соответствии с требованиями пп. 7.5.2 стандарта ISO 9001, организация должна валидировать любые процессы производства и предоставления услуг, результаты (результирующий выход) которых нельзя проверить посредством последующего мониторинга или измерения, и как следствие, недостатки которых становятся очевидными только после начала использования продукции или предоставления услуги.
Из требования стандарта следует, что критерием для отнесения ЛЮБЫХ ПРОЦЕССОВ организации к валидируемым является то, что их НЕЛЬЗЯ верифицировать последующими мониторингом и измерениями. А в чем же причины этого самого "нельзя"?
Первая причина состоит в том, что организация этими процессами завершает свои производственные процессы (процессы предоставления услуги), передает результаты своей деятельности для начала использования потребителю/заказчику и НЕ ИМЕЕТ ДАЛЬНЕЙШИХ ПОЛНОМОЧИЙ по их верификации последующими мониторингом и измерениями.
Вторая причина заключается в том, что результат какого-либо процесса на соответствующей стадии производства или оказания услуги БУДЕТ СКРЫТ ПОСЛЕДУЮЩИМИ РАБОТАМИ, и подтверждение его соответствия в конечной продукции будет либо невозможно, либо затруднено или экономически нецелесообразно.
Таким образом, к процессам организации, подлежащим валидации, следует отнести:
все процессы, которыми завершается изготовление продукции или предоставление услуги - ФИНИШНЫЕ ПРОЦЕССЫ. В отношении готовой продукции, полученной в результате финишных процессов, должно быть принято решение о возможности ее использования и применения по назначению перед передачей потребителю/заказчику;
все процессы, результаты которых будут скрыты при выполнении последующих процессов (стадий, этапов) - СПЕЦИАЛЬНЫЕ ПРОЦЕССЫ. В отношении той части продукции, которая будет скрыта последующими работами и не будет проверяться с помощью измерений и дальнейшего мониторинга, уже на этапе производства должно быть принято решение о ее соответствии установленным требованиям и, фактически, о возможности ее использования и применения по назначению.
Шаг 2. Определить необходимую деятельность организации при валидации процессов производства и предо ставления услуг. В соответствии с требованиями пп. 3.8.5 стандарта ISO 9000 валидация - подтверждение на основе представления объективных свидетельств того, что требования, предназначенные для конкретного использования или применения, выполнены.
Объективными свидетельствами (пп. 3.8.1 стандарта ISO 9000) являются данные, подтверждающие наличие или истинность чего-либо, которые могут быть получены путем наблюдения, измерения, испытания или другими способами.
Задачей организации является определение и получение объективных свидетельств для финишных и специальных процессов (см. шаг 1).
В общем случае такими объективными свидетельствами являются:
для финишных процессов - результаты приемосдаточных, периодических, квалификационных, типовых испытаний, испытаний на надежность, комплекты исполнительной документации и т. п.;
для специальных процессов - результаты приемки и/или освидетельствования скрытых работ, отдельно предъявляемых операций, операционного контроля и т. п.
Для их получения необходимо:
определить, разработать и утвердить процедуры создания, наблюдения, контроля, испытаний, верификации с установлением критериев для анализа, применением соответствующего оборудования, определением необходимой квалификации и ответственности персонала и требуемых записей. Как правило, это технические условия, программы и методики испытаний, инструкции, технологические процессы, технологические и операционные карты и т. п.
провести необходимые наблюдения, контроль и измерения, испытания и т. п. с применением конкретных методов и процедур, при этом условия, в которых проводятся испытания, могут быть реальными (например, испытание автомобиля на треке, отстрел боеприпасов на полигоне и т. п.) или смоделированными (например, проверка с использованием барокамеры, вибростенда, термокамеры, центрифуги и т. п.) в лабораторных условиях для имитации реальных (а чаше, более жестких) условий эксплуатации;
оформить и представить в требуемом виде результаты наблюдения, контроля, измерений, испытания и т. п. (т. е. деятельности, предпринимаемой для установления пригодности, адекватности, результативности рассматриваемой деятельности (объекта) для достижения установленных целей). Как правило, это протоколы приемо-сдаточных испытаний, акты периодических, типовых испытаний, испытаний на надежность, акты освидетельствования скрытых работ и приемки ответственных конструкций, исполнительная документация и т. п.
Далее следует этап принятия решения (подтверждения) на основе полученных объективных свидетельств того, что требования, предназначенные для КОНКРЕТНОГО использования или применения, выполнены. При реализации этого этапа необходимо:
Провести анализ полученных свидетельств, оценить их объективность, полноту и достаточность для принятия решения о годности продукции (предоставленной услуги) к применению и/или использованию по назначению;
Принять решение о годности продукции (предоставленной услуги) к применению и/или использованию по назначению и оформить документы, удостоверяющие приемку продукции/этапа работ. Как правило, такое решение оформляется в виде заключения, которое подписывают первые лица организации, и включается в формуляры (паспорта) на продукцию или иные документы: акты освидетельствования скрытых работ, приемки ответственных конструкций и т. п. В принятии решения, если это определено, могут участвовать потребители/заказчики, представители заказчика, государственных органов и т. п. После подписания заключения продукция приобретает статус "принятой" (а этап работ считается завершенным) и подлежит отгрузке (передаче) потребителю/заказчику для использования/применения по назначению, или передаче на ответственное хранение. Вот и все. Пройдя эти два шага, мы пришли к пониманию того, что в рамках требований стандарта ISO 9001:
валидация - процесс принятия и оформления решения о годности результата валидируемого процесса к применению/использованию по назначению, демонстрирующий его способность достигать запланированных результатов;
специальные процессы - процессы, результаты которых будут скрыты при выполнении последующих процессов (стадий, этапов).
Следуя принципу постоянного улучшения СМК, организация при проведении валидации может принимать во внимание различные вопросы, касающиеся:
анализа претензий потребителей (как внешних, так и внутренних) и других заинтересованных сторон;
анализа условий применения (эксплуатации, использования);
своевременности и адекватности принятых в организации корректирующих и предупреждающих действий, устранения несоответствий, выявленных по результатам внутренних аудитов;
изменений процессов, характеристик продукции, нормативных требований;
применения новых прогрессивных технологий, оборудования, повышения квалификации персонала и т. п.
Вот тогда и могут появиться документы, содержащие результаты обобщенного анализа. Причем не только для процессов, подлежащих валидации, но и для любых процессов организации. Но это уже совсем другая история, которая может развиваться в рамках стандарта ISO 9004.
Иванов А.Н., Чазова А.В.